المفاهيم الأساسية
がん細胞の好気的解糖代謝から嫌気的解糖代謝への切り替え(ワールブルグ効果)により蓄積した乳酸がNBS1のラクチル化を促進し、ホモロジー組換え修復を活性化させることで、DNA修復能力を高め、化学療法耐性を獲得する。
الملخص
本研究は、がん細胞のワールブルグ効果によって蓄積した乳酸が、DNA修復タンパク質NBS1のラクチル化を促進し、ホモロジー組換え修復を活性化させることで、がん細胞の化学療法耐性獲得に寄与することを明らかにした。
具体的には以下の知見が得られた:
- NBS1のK388残基のラクチル化が、MRE11-RAD50-NBS1(MRN)複合体の形成と、DNA二本鎖切断部位へのホモロジー組換え修復タンパク質の集積に必須である。
- NBS1のラクチル化酵素はTIP60、脱ラクチル化酵素はHDAC3である。
- NBS1のK388ラクチル化レベルが高いほど、術前化学療法に対する予後が悪い。
- LDHA欠損やLDHA阻害剤stiripentolによる乳酸産生抑制は、NBS1のラクチル化を減少させ、DNA修復能力を低下させ、化学療法耐性を克服する。
以上より、がん細胞の乳酸代謝がDNA修復機構を制御し、化学療法耐性獲得に寄与することが明らかになった。乳酸産生抑制は新たな治療戦略となる可能性がある。
تخصيص الملخص
إعادة الكتابة بالذكاء الاصطناعي
إنشاء الاستشهادات
ترجمة المصدر
إلى لغة أخرى
إنشاء خريطة ذهنية
من محتوى المصدر
زيارة المصدر
www.nature.com
NBS1 lactylation is required for efficient DNA repair and chemotherapy resistance - Nature
الإحصائيات
NBS1のK388ラクチル化は、MRN複合体形成とDNA二本鎖切断部位へのホモロジー組換え修復タンパク質の集積に必須である。
NBS1のK388ラクチル化レベルが高いほど、術前化学療法に対する予後が悪い。
LDHA欠損やLDHA阻害剤stiripentolによる乳酸産生抑制は、NBS1のラクチル化を減少させ、DNA修復能力を低下させ、化学療法耐性を克服する。
اقتباسات
「乳酸蓄積がNBS1のラクチル化を促進し、ホモロジー組換え修復を活性化させることで、がん細胞の化学療法耐性獲得に寄与する」
「NBS1のK388ラクチル化レベルが高いほど、術前化学療法に対する予後が悪い」
「乳酸産生抑制は新たな治療戦略となる可能性がある」
الرؤى الأساسية المستخلصة من
by Hengxing Che... في www.nature.com 07-03-2024
https://www.nature.com/articles/s41586-024-07620-9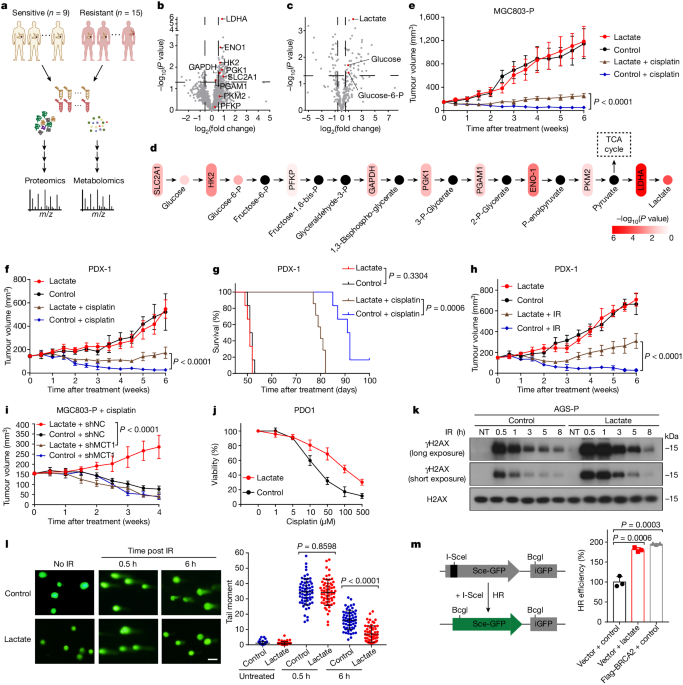
استفسارات أعمق
乳酸以外の代謝産物がDNA修復機構に与える影響はどのようなものか?
乳酸以外の代謝産物もDNA修復機構に影響を及ぼす可能性があります。例えば、ピルビン酸やアセチルCoAなどの代謝産物は、細胞内のエネルギー代謝経路に関与しており、これらの代謝産物の濃度変化がDNA修復経路に影響を与えることが知られています。特定の代謝産物がDNA修復タンパク質の機能や相互作用に影響を及ぼすことで、修復効率や薬剤耐性に変化が生じる可能性があります。
NBS1以外のDNA修復タンパク質のポストトランスレーショナル修飾による制御機構はあるのか?
NBS1以外のDNA修復タンパク質もポストトランスレーショナル修飾によって制御されることがあります。例えば、RAD50やMRE11などのDNA修復タンパク質は、リン酸化やアセチル化などの修飾を受けることで、修復経路への参加や修復速度が調節されることが知られています。これらの修飾は、DNA損傷応答や薬剤感受性に影響を与える重要な役割を果たしています。
乳酸産生抑制以外の代謝標的治療法の可能性はどのようなものが考えられるか?
乳酸産生抑制以外の代謝標的治療法としては、例えばグルコース代謝経路やシトクロムオキシダーゼなどの他の代謝関連タンパク質を標的とする治療法が考えられます。これらの治療法は、がん細胞の代謝特性に着目し、細胞内のエネルギー代謝や栄養摂取を阻害することでがん細胞の増殖や生存を抑制することが期待されます。さらに、特定の代謝経路やタンパク質を標的とする新たな治療法の開発が進められることで、がん治療の選択肢が拡大する可能性があります。
0
