l-락테이트가 cGAS의 전반적인 라이신 락틸화 효소로 작용하는 AARS1 및 AARS2의 역할
Kernekoncepter
AARS1과 AARS2는 세포 내 l-락테이트 센서로 작용하여 cGAS의 락틸화와 불활성화를 매개한다.
Resumé
이 연구는 l-락테이트가 단백질 락틸화를 통해 세포 기능을 조절하는 과정을 규명했다. 연구진은 AARS1과 AARS2가 l-락테이트를 감지하고 ATP 의존적으로 cGAS를 락틸화하여 불활성화시킨다는 것을 밝혀냈다.
구체적으로, AARS1/2는 미세몰 수준의 l-락테이트 결합 친화도를 가지며, 직접적으로 cGAS를 락틸화한다. 이를 통해 cGAS의 액체-액체 상 분리와 DNA 감지 기능이 억제된다. 또한 AARS2가 l-락테이트 존재 시 cGAS와 결합하여 이 과정을 매개한다.
이러한 락틸화 기전은 생물체 수준에서도 관찰되었는데, 마우스 실험에서 락틸화 모방 돌연변이는 cGAS를 억제하고 락틸화 저항성 돌연변이는 이를 보호하는 것으로 나타났다. 더불어 MCT1 차단제 투여가 스트레스 상황에서 cGAS 락틸화를 억제하고 선천면역 감시를 회복시켜 바이러스 복제를 억제하는 것으로 확인되었다.
종합하면, AARS1/2는 진화적으로 보존된 l-락테이트 센서이자 락틸화 효소로, 이를 통해 cGAS의 불활성화와 면역 회피를 매개한다. 이는 대사와 면역의 연계 기전을 보여주는 중요한 발견이다.
Tilpas resumé
Genskriv med AI
Generer citater
Oversæt kilde
Til et andet sprog
Generer mindmap
fra kildeindhold
Besøg kilde
www.nature.com
AARS1 and AARS2 sense l-lactate to regulate cGAS as global lysine lactyltransferases - Nature
Statistik
AARS1과 AARS2는 l-락테이트에 대해 미세몰 수준의 결합 친화도를 가진다.
AARS2는 l-락테이트 존재 시 cGAS와 결합한다.
락틸화 모방 돌연변이는 cGAS를 억제하고, 락틸화 저항성 돌연변이는 이를 보호한다.
MCT1 차단제 투여는 스트레스 상황에서 cGAS 락틸화를 억제하고 선천면역 감시를 회복시켜 바이러스 복제를 억제한다.
Citater
"AARS1/2 and the evolutionarily conserved Escherichia coli orthologue AlaRS bind to l-lactate with micromolar affinity and they directly catalyse l-lactate for ATP-dependent lactylation on the lysine acceptor end."
"In response to l-lactate, AARS2 associates with cyclic GMP–AMP synthase (cGAS) and mediates its lactylation and inactivation in cells and in mice."
"By establishing a genetic code expansion orthogonal system for lactyl-lysine incorporation, we demonstrate that the presence of a lactyl moiety at a specific cGAS amino-terminal site abolishes cGAS liquid-like phase separation and DNA sensing in vitro and in vivo."
Vigtigste indsigter udtrukket fra
by Heyu Li,Chao... kl. www.nature.com 09-25-2024
https://www.nature.com/articles/s41586-024-07992-y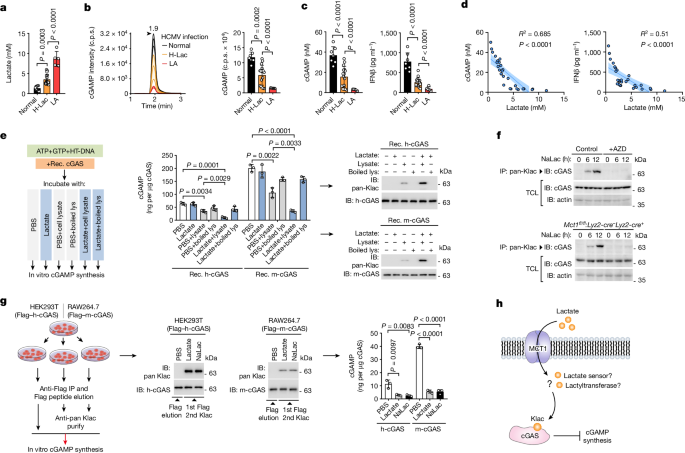
Dybere Forespørgsler
l-락테이트 감지와 cGAS 락틸화 이외에 AARS1/2가 관여할 수 있는 다른 대사 및 면역 조절 기전은 무엇일까?
AARS1과 AARS2는 l-락테이트 감지 및 cGAS 락틸화 외에도 다양한 대사 및 면역 조절 기전에 관여할 가능성이 높습니다. 이들 효소는 아미노산의 활성화와 tRNA의 결합을 통해 단백질 합성에 중요한 역할을 하며, 이는 세포의 대사 상태와 밀접하게 연관되어 있습니다. 예를 들어, AARS1/2는 세포 내 에너지 상태를 반영하는 신호로 작용할 수 있으며, 이는 대사 스트레스 상황에서 면역 반응을 조절하는 데 기여할 수 있습니다. 또한, AARS1/2는 다른 단백질의 락틸화 또는 아세틸화와 같은 포스트 번역 수정 과정에 관여하여 면역 세포의 활성화 및 염증 반응을 조절할 수 있습니다. 이러한 기전은 특히 대사 질환이나 염증성 질환에서 면역 반응의 조절에 중요한 역할을 할 수 있습니다.
AARS1/2 이외에 다른 락틸화 효소가 존재할 가능성은 없는가?
AARS1/2 외에도 다른 락틸화 효소가 존재할 가능성이 있습니다. 현재 연구는 AARS1/2가 주요 락틸화 효소로 밝혀졌지만, 다른 효소들이 락틸화 반응에 관여할 수 있는 가능성은 열려 있습니다. 예를 들어, 다른 아미노산 합성 효소나 특정 효소들이 l-락테이트와 같은 대사 산물에 반응하여 단백질의 락틸화를 촉진할 수 있습니다. 또한, 다양한 세포 유형이나 조직에서 락틸화의 역할이 다를 수 있기 때문에, 추가적인 연구를 통해 새로운 락틸화 효소의 발견이 이루어질 수 있습니다. 이러한 발견은 락틸화의 생리학적 및 병리학적 역할을 이해하는 데 중요한 기초가 될 것입니다.
이러한 대사-면역 연계 기전이 다른 질병 상황에서도 관찰되는지, 그리고 이를 활용한 치료법 개발 가능성은 어떨까?
대사-면역 연계 기전은 다양한 질병 상황에서 관찰되고 있으며, 특히 대사 질환, 염증성 질환, 암 및 감염 질환에서 중요한 역할을 합니다. 예를 들어, 비만이나 당뇨병과 같은 대사 질환에서는 대사 산물의 변화가 면역 세포의 기능에 영향을 미쳐 염증 반응을 유발할 수 있습니다. 이러한 기전을 활용한 치료법 개발 가능성은 매우 높습니다. AARS1/2의 기능을 조절하거나, 락틸화 경로를 타겟으로 하는 약물 개발은 면역 반응을 조절하고 질병의 진행을 억제하는 데 기여할 수 있습니다. 또한, MCT1 차단제와 같은 대사 조절제가 면역 감시를 회복시키고 바이러스 복제를 억제하는 데 효과적일 수 있음을 보여주었습니다. 따라서, 이러한 대사-면역 연계 기전을 기반으로 한 새로운 치료 전략은 향후 연구에서 중요한 방향이 될 것입니다.
0
