高鉄転移受容体標的キメラによるメンブレンタンパク質の分解
מושגי ליבה
癌細胞は急速な増殖のために高レベルの鉄を必要とし、細胞表面の転移受容体1(TfR1)を大幅に上方制御する。この現象と TfR1 の高速エンドサイトーシス速度を利用して、TransTACs と呼ばれる膜タンパク質分解のためのヘテロ二重特異性抗体モダリティを開発した。
תקציר
本研究では、癌細胞の高い鉄需要と TfR1 の高速エンドサイトーシスを利用して、TransTACs と呼ばれる新しい膜タンパク質分解技術を開発した。TransTACs は、標的タンパク質と TfR1 を迅速に共内在化させ、標的タンパク質をリソソーム分解経路に導くよう設計されている。
TransTACs は、上皮増殖因子受容体、プログラムされた細胞死1リガンド1、CD20、キメラ抗原受容体など、さまざまな単一通過膜タンパク質、多重通過膜タンパク質、天然型または合成膜タンパク質を効率的に分解できることを示した。
TransTACs は、ヒト初代キメラ抗原受容体T細胞の可逆的制御や、エクソン19欠失/T790M/C797S変異を持つ薬剤耐性上皮増殖因子受容体駆動肺がんのマウスキセノグラフトモデルでの標的治療など、さまざまな応用例を示した。TransTACs は、膜タンパク質の精密な操作と標的がん治療のための有望な新しい二機能性抗体ファミリーを表している。
התאם אישית סיכום
כתוב מחדש עם AI
צור ציטוטים
תרגם מקור
לשפה אחרת
צור מפת חשיבה
מתוכן המקור
עבור למקור
www.nature.com
Transferrin receptor targeting chimeras for membrane protein degradation - Nature
סטטיסטיקה
癌細胞は急速な増殖のために高レベルの鉄を必要とする。
TfR1 は細胞表面で大幅に上方制御される。
TfR1 は高速なエンドサイトーシス速度を持つ。
ציטוטים
"TransTACs are engineered to drive rapid co-internalization of a target protein of interest and TfR1 from the cell surface, and to enable target protein entry into the lysosomal degradation pathway."
"TransTACs can efficiently degrade a diverse range of single-pass, multi-pass, native or synthetic membrane proteins, including epidermal growth factor receptor, programmed cell death 1 ligand 1, cluster of differentiation 20 and chimeric antigen receptor."
תובנות מפתח מזוקקות מ:
by Dingpeng Zha... ב- www.nature.com 09-25-2024
https://www.nature.com/articles/s41586-024-07947-3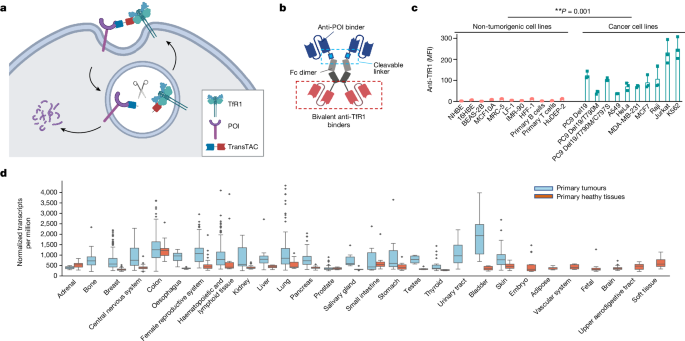
שאלות מעמיקות
TransTACs の作用機序をさらに詳しく説明できますか?
TransTACs(トランスフェリン受容体標的キメラ抗体)は、細胞表面のトランスフェリン受容体1(TfR1)を利用して、特定の膜タンパク質を迅速に内部化し、リソソーム経路を介して分解を促進する新しい抗体モダリティです。具体的には、TransTACsは二つの異なる抗体部分から構成されており、一方はTfR1に結合し、もう一方はターゲットとする膜タンパク質に特異的に結合します。この結合により、TfR1とターゲットタンパク質が同時に細胞内に取り込まれ、リソソームに送られます。リソソーム内での分解により、ターゲットタンパク質の量が減少し、これが細胞の機能や生存に影響を与えることが期待されます。このメカニズムは、特にがん細胞において、過剰に発現している膜タンパク質を標的にすることで、がん治療における新たなアプローチを提供します。
TransTACs の長期的な安全性と副作用はどのように評価されていますか?
TransTACsの長期的な安全性と副作用の評価は、主に前臨床試験および臨床試験を通じて行われます。前臨床段階では、動物モデルを用いてTransTACsの投与後の生理的反応や毒性を観察します。特に、免疫系への影響や、他の正常細胞への非特異的な影響を評価することが重要です。また、TransTACsがターゲットとする膜タンパク質の特異性が高いため、オフターゲット効果が少ないことが期待されます。臨床試験では、患者に対する安全性を評価し、長期的な副作用やアレルギー反応の発生をモニタリングします。これにより、TransTACsの使用に伴うリスクを最小限に抑えつつ、効果的ながん治療を実現することが目指されています。
TransTACs の応用範囲をどのように拡大できますか?膜タンパク質以外の標的への応用は可能でしょうか?
TransTACsの応用範囲は、膜タンパク質の分解にとどまらず、他の種類のタンパク質や細胞内のシグナル伝達経路の調節にも拡大する可能性があります。例えば、細胞内のシグナル伝達に関与するタンパク質や、特定の疾患に関連する細胞内の酵素を標的にすることで、より広範な治療効果を得ることができるかもしれません。また、TransTACsの設計を工夫することで、細胞外マトリックスや細胞内の特定の構造に結合することも可能です。さらに、TransTACsの技術を応用して、特定の細胞タイプや組織に特異的に作用するように設計された新しい治療法の開発が期待されます。これにより、がん治療だけでなく、自己免疫疾患や感染症など、さまざまな疾患に対する新たな治療戦略が生まれる可能性があります。
0
