ペプチド結合による新規アロステリック制御可能なタンパク質アセンブリの設計
本研究では、アロステリック制御の機構を理解し、ペプチド結合によって調節可能な合成タンパク質アセンブリを設計することを目的としている。
自然界のアロステリック制御タンパク質では、多数のアミノ酸残基にわたる微妙な立体構造変化が特徴的であるが、これを模倣することは大きな課題である。
そこで本研究では、Monod-Wyman-Changeux モデルに着想を得て、ペプチド結合によって引き起こされる剛体ボディの結合を利用することで、様々なアロステリック制御可能なタンパク質アセンブリを設計した。
具体的には、ペプチド結合によって引き起こされる構造変化を、タンパク質間の相互作用に結び付けることで、サブユニットの取り込みや放出、四面体ケージの解体などの現象を実現した。
サイズ排除クロマトグラフィー、質量光度計測、電子顕微鏡観察の結果、これらの設計したアロステリック制御タンパク質アセンブリは、ペプチド結合の有無に関わらず、設計モデルに非常によく一致していることが示された。
さらに、これらのシステムはヘモグロビンなどの自然界のアロステリック制御タンパク質と同程度のリガンド結合協調性を示すことが明らかになった。
本研究の成果は、最適化された側鎖-側鎖間のアロステリック伝達経路を必要とせずに、タンパク質サブ構造の全体的なエネルギー結合によってアロステリー制御が生み出されることを示している。
また、アロステリック制御可能な送達システム、タンパク質ナノマシン、細胞内フィードバック制御回路の開発につながる指針を提供するものと期待される。
Összefoglaló testreszabása
Átírás mesterséges intelligenciával
Hivatkozások generálása
Forrás fordítása
Egy másik nyelvre
Gondolattérkép létrehozása
a forrásanyagból
Forrás megtekintése
www.nature.com
De novo design of allosterically switchable protein assemblies - Nature
Főbb Kivonatok
by Arvind Pilla... : www.nature.com 08-14-2024
https://www.nature.com/articles/s41586-024-07813-2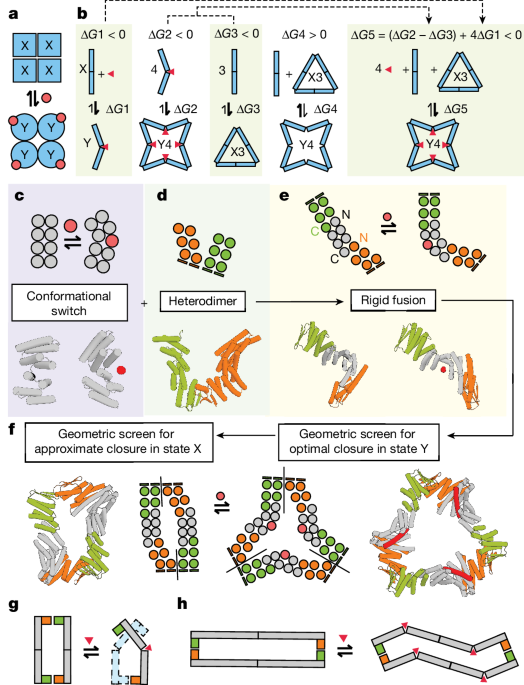
Mélyebb kérdések
