Temel Kavramlar
LYCHOSはコレステロール依存的にmTORC1を活性化する細胞内コレステロールセンサーである。その構造はプラントのオーキシントランスポーターと哺乳類のGPCRドメインを融合した特殊な膜タンパク質である。
Özet
本研究では、LYCHOSタンパク質の高分解能クライオ電子顕微鏡構造を解明した。LYCHOSは膜貫通型のホモダイマー構造をとり、トランスポーターライクドメインとGPCRドメインが融合した特殊な構造を持つことが明らかになった。
GPCRドメインはアポ状態で、トランスポーターライクドメインの表面に結合している。この構造は珍しい例である。
コレステロール結合モチーフはGPCRドメインとトランスポーターライクドメインの間に位置しており、コレステロールセンシングに関与している。
トランスポーターライクドメインはプラントのオーキシントランスポーターPINファミリーのオルソログであり、ヒトの既知のトランスポーターよりもプラントのオーキシントランスポーターに構造的に類似していることが分かった。
活性実験の結果から、LYCHOSのトランスポーターライクドメインとGPCRドメインが協調してコレステロールを感知し、mTORC1の活性化を調節していることが示唆された。
Özeti Özelleştir
Yapay Zeka ile Yeniden Yaz
Alıntıları Oluştur
Kaynağı Çevir
Başka Bir Dile
Zihin Haritası Oluştur
kaynak içeriğinden
Kaynak
www.nature.com
LYCHOS is a human hybrid of a plant-like PIN transporter and a GPCR - Nature
İstatistikler
LYCHOSはコレステロール依存的にmTORC1を活性化する。
LYCHOSはホモダイマーの膜貫通型タンパク質である。
Alıntılar
LYCHOSはコレステロールセンシングを媒介する保存されたコレステロール結合モチーフを持つ。
LYCHOSのトランスポーターライクドメインはプラントのオーキシントランスポーターPINファミリーのオルソログである。
Önemli Bilgiler Şuradan Elde Edildi
by Charles Bayl... : www.nature.com 10-02-2024
https://www.nature.com/articles/s41586-024-08012-9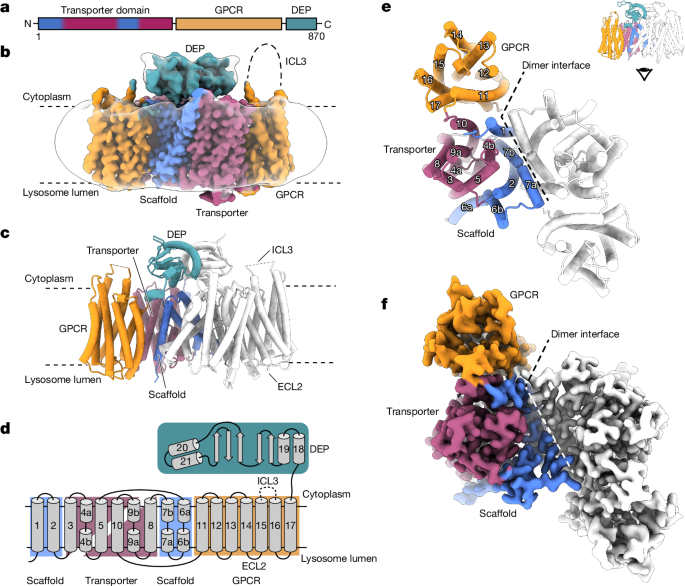
Daha Derin Sorular
LYCHOSの進化的起源はどのようなものか、プラントとヒトの融合はどのように起こったのか。
LYCHOS(GPR155)は、植物のPIN輸送体とヒトのGタンパク質共役受容体(GPCR)の融合体であり、その進化的起源は非常に興味深いものです。LYCHOSのトランスポータードメインは、植物のPIN-FORMED(PIN)オーキシン輸送体ファミリーのオルソログであり、これにより植物とヒトの間に進化的な関連性が示唆されます。この融合は、古代の共通祖先からの遺伝子の水平伝播や、進化の過程での遺伝子重複、または異なる生物種間での遺伝子の再利用によって起こった可能性があります。特に、LYCHOSの構造が植物のオーキシン輸送体に類似していることは、植物と動物の細胞間のシグナル伝達や代謝調節における進化的な適応を示唆しています。
LYCHOSの活性制御機構にはどのような生理学的意義があるのか。
LYCHOSは、コレステロールセンサーとして機能し、mTORC1(メカニスティックターゲットオブラパマイシン複合体1)の活性化を調節する重要な役割を果たしています。この活性制御機構は、細胞の栄養状態やエネルギーの可用性に応じて細胞成長や代謝を調整するために不可欠です。具体的には、LYCHOSはコレステロールの存在を感知し、これに基づいてmTORC1の活性を調整することで、細胞の成長や代謝のバランスを保つことができます。この機構は、細胞の恒常性を維持し、異常な細胞成長や代謝異常を防ぐために重要です。
LYCHOSの機能異常がどのような疾患につながるのか、治療標的としての可能性はあるか。
LYCHOSの機能異常は、代謝関連疾患やがんなどの疾患に関連している可能性があります。特に、mTORC1の異常な活性化は、がん細胞の増殖や生存に寄与することが知られており、LYCHOSの機能不全がこれに影響を与える可能性があります。また、代謝症候群や心血管疾患においても、コレステロールの感知と調節が重要であるため、LYCHOSの異常がこれらの疾患の発症に寄与することが考えられます。したがって、LYCHOSは新たな治療標的としての可能性を秘めており、LYCHOSの機能を調節する薬剤の開発は、これらの疾患に対する新しい治療戦略を提供するかもしれません。
0
