2023年のノーベル医学賞は、遺伝子活性の制御における根本的な原則であるマイクロRNAを発見した2人のアメリカ人研究者、Victor Ambros氏とGary Ruvkun氏に授与されました。Ambros氏はマサチューセッツ大学医学部の研究者で、Ruvkun氏はハーバード大学医学部の遺伝学教授です。
マイクロRNAの発見
Ambros氏とRuvkun氏は、1980年代後半に線虫C. elegansを用いた研究で、発生段階における特定の遺伝子の活性化に欠陥を持つlin-4とlin-14という2つの変異体を調べました。Ambros氏は、lin-4がlin-14の負の調節因子であることを示唆していましたが、そのメカニズムは不明でした。
Ambros氏はその後、lin-4がタンパク質合成のコードを持たない非常に短いRNA分子を生成することを発見しました。一方、Ruvkun氏は、lin-4によるlin-14の抑制は、lin-14 mRNAの産生ではなく、タンパク質合成の段階で起こることを示しました。
2人は共同で研究を進め、lin-4の短い配列がlin-14 mRNAの特定の部分と相補的であることを発見しました。さらに実験を重ねた結果、lin-4マイクロRNAがlin-14 mRNAに結合することでlin-14タンパク質の産生を阻害し、lin-14の発現を抑制することが明らかになりました。これは、マイクロRNAという未知のRNAによる遺伝子制御という新しい原理の発見でした。
マイクロRNAの重要性
当初、この発見はあまり注目されませんでしたが、2000年にRuvkun氏の研究グループがlet-7という別のマイクロRNAを発見したことで、注目が集まりました。let-7は動物界全体に広く保存されており、その後、数百種類ものマイクロRNAが発見されました。
現在では、ヒトには1000種類以上のマイクロRNAが存在し、すべての多細胞生物においてマイクロRNAによる遺伝子制御が行われていることが分かっています。マイクロRNAは、mRNAの分解やタンパク質合成の阻害を通じて遺伝子発現を抑制します。1つのマイクロRNAが複数の遺伝子を制御したり、逆に、1つの遺伝子が複数のマイクロRNAによって制御されたりすることで、複雑な遺伝子ネットワークが形成されています。
マイクロRNAは、細胞や組織の正常な発生に不可欠であり、その異常はがんやその他の疾患を引き起こす可能性があります。マイクロRNAは、植物のウイルス感染防御など、他の生物学的プロセスにも関与しています。
ノーベル賞受賞の意義
Ambros氏とRuvkun氏の発見は、遺伝子制御の理解に革命をもたらし、生物学や医学の分野に大きな影響を与えました。マイクロRNAは、がんやその他の疾患の新しい治療法の開発における有望な標的となっています。
客製化摘要
使用 AI 重寫
產生引用格式
翻譯原文
翻譯成其他語言
產生心智圖
從原文內容
前往原文
www.medscape.com
Nobel Prize in Medicine Awarded to MicroRNA Researchers
從以下內容提煉的關鍵洞見
by Michael Van ... 於 www.medscape.com 10-08-2024
https://www.medscape.com/viewarticle/nobel-prize-medicine-awarded-microrna-researchers-2024a1000ido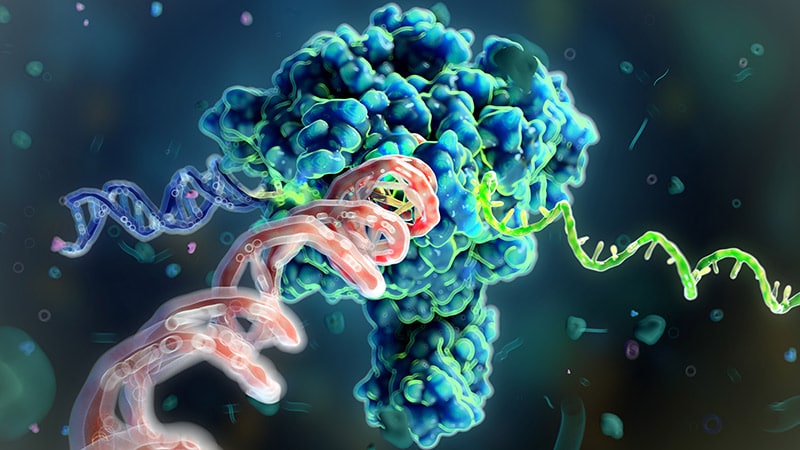
深入探究
