核心概念
視床下部の神経細胞において、空腹を促進する NPY と満腹を促進するαMSH という神経ペプチドが cAMP 濃度を介して競合的に作用し、摂食行動と飽和感を制御している。
摘要
本研究は、視床下部室傍核の MC4R 発現ニューロン (PVHMC4R) における神経ペプチド NPY とαMSH の役割を調査したものです。
NPY とαMSH の競合作用
- 空腹時には NPY が優勢となり、PVHMC4R ニューロン内のセカンドメッセンジャーである cAMP 濃度を低下させる。
- 満腹時にはαMSH が優勢となり、cAMP 濃度を上昇させる。
- NPY とαMSH は、cAMP 濃度を制御することで競合的に作用し、摂食行動を調節する。
摂食時の NPY とαMSH の動態
- 摂食によりαMSH の放出が促進され、NPY の放出が抑制される。
- その結果、摂食中は cAMP 濃度が上昇した状態が維持される。
cAMP 濃度と飽和感
- 上昇した cAMP 濃度は、摂食関連の興奮性入力の potentiation を促進する。
- この potentiation が徐々に進行することで、数分かけて飽和感が高まる。
結論
本研究は、神経ペプチド NPY とαMSH が cAMP 濃度を介して競合的に作用することで、摂食行動と飽和感を制御していることを明らかにしました。この発見は、摂食障害の治療法開発に貢献する可能性があります。
客製化摘要
使用 AI 重寫
產生引用格式
翻譯原文
翻譯成其他語言
產生心智圖
從原文內容
前往原文
www.nature.com
Stochastic neuropeptide signals compete to calibrate the rate of satiation - Nature
統計資料
NPY とαMSH の放出は、約 100 µm の範囲内の複数のニューロンに影響を与える。
引述
"Each release event is all-or-none, stochastic and can impact multiple neurons within an approximately 100-µm-diameter region."
"Feeding resolves this competition by simultaneously elevating αMSH release and suppressing NPY release, thereby sustaining elevated cAMP in PVHMC4R neurons throughout a meal."
從以下內容提煉的關鍵洞見
by Stephen X. Z... 於 www.nature.com 11-06-2024
https://www.nature.com/articles/s41586-024-08164-8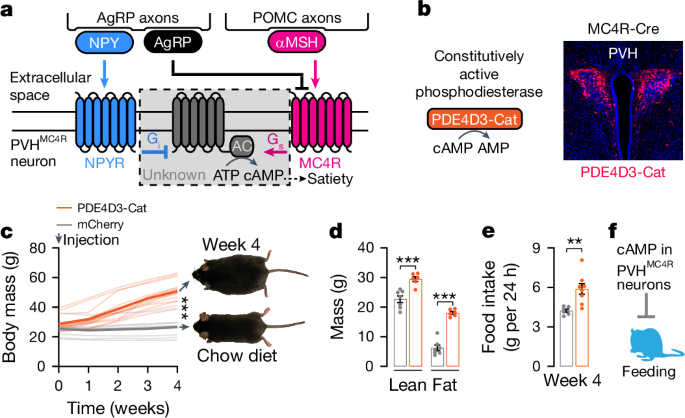
深入探究
NPY とαMSH のバランスが崩れると、どのような摂食障害が引き起こされるのか?
NPYとαMSHは、それぞれ食欲増進と食欲抑制に働く神経ペプチドであり、これらは視床下部の室傍核(PVH)にあるMC4R発現ニューロン(PVHMC4Rニューロン)において相互に拮抗的に作用することで、摂食行動を制御しています。
これらのバランスが崩れると、以下のような摂食障害が引き起こされる可能性があります。
NPY が過剰な場合:
過食: NPYは強力な食欲増進作用を持つため、過剰になると摂食行動が亢進し、過食につながる可能性があります。
肥満: 過食の結果として、エネルギー摂取量が消費量を上回り、肥満のリスクが高まります。
レプチン抵抗性: NPYの過剰な分泌は、食欲を抑制するホルモンであるレプチンの感受性を低下させる可能性があり、これがさらなる過食と体重増加を招く可能性があります。
αMSH が不足する場合:
食欲不振: αMSHは食欲抑制効果を持つため、不足すると食欲が減退し、食欲不振や拒食につながる可能性があります。
やせ: 食欲不振の結果として、十分なエネルギーを摂取できず、体重減少や低体重につながる可能性があります。
両者のバランス異常:
摂食パターンの乱れ: NPYとαMSHのバランス異常は、食事のタイミングや量の異常、満腹感の異常などを引き起こし、摂食パターンの乱れにつながる可能性があります。
これらの摂食障害は、遺伝的な要因、ストレス、生活習慣の乱れなど、様々な要因によって引き起こされる可能性があります。
cAMP 濃度以外のメカニズムで、摂食行動が制御されている可能性はあるのか?
はい、cAMP濃度以外のメカニズムも摂食行動の制御に関わっています。
神経伝達物質: 摂食行動は、セロトニン、ドーパミン、 GABAなど、cAMP経路とは異なるシグナル伝達経路を持つ神経伝達物質によっても制御されています。
例えば、セロトニンは満腹感に関与し、その受容体作動薬は食欲抑制剤として用いられています。
ドーパミンは食物報酬、快感、モチベーションに関与しており、摂食行動の開始や持続に影響を与えます。
ホルモン: グレリン、レプチン、インスリンなどのホルモンは、脳に作用して食欲や代謝を調節しています。
グレリンは胃から分泌され、食欲増進作用があります。
レプチンは脂肪細胞から分泌され、食欲抑制やエネルギー消費促進作用があります。
インスリンは膵臓から分泌され、血糖値を低下させる働きとともに、脳に作用して食欲を抑制します。
腸内細菌叢: 腸内細菌叢は、食物の消化吸収に関与するだけでなく、神経系や免疫系を通じて脳にシグナルを送り、摂食行動に影響を与える可能性が示唆されています。
その他の因子: その他にも、ストレス、睡眠、体内時計、味覚や嗅覚などの感覚情報も摂食行動に影響を与えます。
このように、摂食行動は複雑なメカニズムによって制御されており、cAMP濃度はその一部に過ぎません。
人工的に神経ペプチドの放出を制御することで、摂食行動をコントロールすることは可能なのか?
人工的に神経ペプチドの放出を制御することで、摂食行動をコントロールできる可能性はあります。
薬剤によるアプローチ:
NPYやαMSHの受容体作動薬や拮抗薬を用いることで、それぞれの神経ペプチドの作用を調節し、摂食行動をコントロールできる可能性があります。
実際、αMSHのアナログであるセトメラノタイドは、食欲抑制効果を示し、肥満治療薬として使用されています。
遺伝子治療:
ウイルスベクターなどを用いて、特定の神経細胞にNPYやαMSHの発現を促進または抑制する遺伝子を導入することで、摂食行動をコントロールできる可能性があります。
このような遺伝子治療は、動物実験レベルではすでに行われており、摂食行動や体重を変化させることに成功しています。
光遺伝学や化学遺伝学:
光遺伝学や化学遺伝学を用いることで、光や薬剤によって特定の神経細胞の活動を制御し、NPYやαMSHの放出を操作できる可能性があります。
これらの技術は、動物実験において摂食行動を精密に制御するために用いられており、将来的にはヒトへの応用も期待されています。
しかし、これらの技術を実用化するためには、いくつかの課題を克服する必要があります。
安全性: 神経ペプチドの放出を操作することで、摂食行動以外の神経機能に影響を与える可能性があり、安全性について慎重な検討が必要です。
有効性: ヒトにおいて、神経ペプチドの放出を制御することで、どの程度の効果が得られるのか、まだ十分に解明されていません。
倫理的な問題: 人工的に摂食行動をコントロールすることの倫理的な問題についても議論が必要です。
これらの課題を克服することで、神経ペプチドの放出を制御する技術は、摂食障害の治療や健康的な食生活の維持に役立つ可能性を秘めています。
0
